中心在拥有2个国家级、3个省级研发转化平台,先后完成国家科技支撑项目2项、省市科研项目36项;研发并产业化14个国内领先药品制剂,其中二类新药2个;通过新药研发、转化和49家生物、医药企业以及11所科研机构建立了紧密的合作;形成了独特的市场、研发、产业化、服务和培训全产业链开发体系。
中心可为诊断试剂、靶向药、疫苗等相关领域企事业单位提供相应的产品技术、通用技术平台、特定技术等开发服务。

1.体外诊断试剂
中心建有符合ISO13485标准的厂房、质检实验室、万级环境检测实验室(微生物限度检测室、无菌检测室、阳性对照室)、低温冷库等设施;配备有先进的酶免、化学发光、胶体金、荧光层析和PCR诊断试剂生产、检测设备;建立了完善的质量管理体系,可从研发、生产、质量检验、风险管理、物料管理、顾客反馈、管理评审、内部审核等多个方面对产品进行质量管理。现可开展如下技术服务:
表1 体外诊断试剂领域技术服务项目
序号 | 服务类别 | 服务内容 |
1 | 打造 技术平台 | 1. 酶免:基于HRP的夹心法、间接法、竞争法定性或定量检测; 2. 化学发光:基于HRP和碱性磷酸酶的夹心法、间接法、竞争法定性或定量检测; 3. 胶体金:夹心法、间接法、竞争法定性或定量检测; 4. 荧光层析:基于铕荧光微球的夹心法、间接法、竞争法定性或定量检测; 5. PCR诊断试剂:普通PCR、荧光定量、 |
2 | 风险分析 | 针对产品所需的技术、政策、物料、环境等进行风险分析评估 |
3 | 主要原材料研究 | 包括抗原、抗体及其他主要原料的选择、制备、质量标准及实验验证研究;质控品的原料选择、制备、定值过程及试验; |
4 | 主要生产工艺及反应体系研究 | 1. 工艺:包被、封闭、标记、 2. 反应条件研究:主要进行反应条件(温度、时间等)、样品加样方式及加样量确定的研究; |
5 | 产品转产 | 提供从实验室规模转向批量生产中试和达产对工艺、质控的优化及产品代工服务; |
6 | 分析性能评估 | 临界值及重复性、分析特异性(交叉反应、干扰物质、Hook效应及样本稀释、试剂盒的样本类型)及阳性判断值确定; |
7 | 稳定性研究 | 反复冻融次数限制、实时稳定性、高温加速破坏稳定性、运输稳定性及开封稳定性等研究 |
8 | 临床阶段 | 严格按照《体外诊断试剂注册管理办法》、《体外诊断试剂临床试验技术指导原则》(国家食品药品监督管理总局通告2014年第16号)开展 |
9 | 产品注册 | 提供注册资料整理、专家审评意见答复等咨询服务 |
2.生物靶向药物
中心拥有9项生物靶向药物专利技术,搭建了新药筛选,毒理、药理、代谢研究,中试工艺探索、优化及放大生产等新药创制、临床前研究和中试工艺开发技术平台,制定了完善的标准化服务流程,现可对外承接生物靶向药的前期药物开发、理化鉴定于功能评价、生物安全、药效于安全、基因工程药物中试等研发服务。
表2 生物靶向药物领域技术服务项目
序号 | 阶段 | 类别 | 服务内容 |
1 | 发现阶段 | 体外药学检测平台 | 生物化学检测、生物物理检测、细胞检测 |
2 | 发现阶段 | 体内药学评价平台 | 全套的临床前药效、药代和毒理评价服务 |
3 | 开发阶段 | 鉴定 | SDS-PAGE, Western Blot, amino acid composition, IEF, HPLC, LC-MS, CE. |
4 | 开发阶段 | 表征 | Amino acid composition, glycosylation analysis, disulfide bond analysis,oxidation, deamidation |
5 | 开发阶段 | 含量 | A280 OD, ELISA, Bradford, Lowry, HPLC |
6 | 开发阶段 | 药效 | Cell-based assay, ADCC, CDC, affinity or binding assay |
7 | 开发阶段 | 纯度 | SEC / IEC / RP-HPLC / CE |
8 | 开发阶段 | 杂质/污染物 | HCD & HCP, residual protein A |
9 | 开发阶段 | 安全性 | Endotoxin, sterility, bioburden |
10 | 工艺开发 | 稳定细胞系和细胞库的构建 | 在GMP条件下建立PCB(原代细胞库), MCB (主细胞库)和WCB(工作细胞库);主要特色:CHO、酵母、原核表达体系,快速筛选稳定细胞株,高表达量、高稳定性。 |
11 | 工艺开发 | 上游工艺开发 | 配备了各种细胞培养系统,包括摇瓶、摇袋式生物反应器和搅拌式生物反应器,可对基础培养基、补料选择与添加方式、生物反应器工艺控制策略等方面进行优化。 |
12 | 工艺开发 | 下游工艺开发 | 澄清过滤工艺开发、层析纯化优化、病毒灭活和病毒过滤等;也可以根据项目的特殊需求,定制工艺,为客户提供一个稳定的、可重复的、可放大的、经济的纯化工艺流程。 |
13 | 制剂研究 | 辅料选择、相容性研究、处方和工艺的研究 | |
14 | 工艺开发 | 小试和中试 | 提供小试药品原液的生产和中试药品制剂的GMP生产。 |
15 | 生产 | 可以为客户提供5、10、20、60L的不锈钢或一次性生物反应器。以满足不同项目的生产需求 | |
16 | 技术转移 | 材料、会议、现场指导等方式,确保研发流程和商业化生产的顺利对接 |
3.疫苗
中心拥有5项鼻喷、注射剂型的疫苗开发专利技术,可对外承接基于大肠杆菌原核表达系统的鼻喷剂、注射剂等预防和治疗性疫苗开发服务。


表3 疫苗领域技术服务项目
序号 | 服务类别 | 服务内容 |
1 | 结构与理化性质研究 | 1.结构式或结构示意图、分子量、分子式;2.生物学活性的关键氨基酸序列或位点、二硫键配对位点、其他翻译后修饰位点;3.与其他化学分子偶联位点;4.原料药/原液的理化特性;5.生物学活性;6.免疫学特性;7.纯度、杂质 |
2 | 种子库 | 1.目的基因的来设计、优化、克隆方法和鉴定;2.宿主细胞(菌)的名称、来源及特性研究;3.重组表达载体导入宿主呃细胞(菌)的方式以及克隆、筛选方法、载体在宿主细胞内的状态(是否整合到染色体内)、拷贝数以及宿主与载体结合后的遗传稳定性,启动和控制克隆基因在宿主细胞中的表达所采用的方法及水平研究;4.工程菌培养特性、生物学特性(基因型和表型)、传代历史(包括驯化过程)、检定、安全性评估; |
3 | 发酵 | 细胞(菌)活率、活细胞(菌)密度、活率、诱导表达条件、目的产物含量、培养基优化、微生物污染监测 |
4 | 纯化工艺 | 1.关键工艺操作时间、维持时间、温度;2.洗脱条件、组分收集、中间体贮存;3.工艺步骤收率、产品相关杂质和工艺相关杂质的去除;4.纯度、生物学活性、收率\杂质残留、代谢产物、目的产物表达量、产品纯度、生物学活性 |
5 | 产品转产 | 提供从实验室规模转向批量生产中试和达产对工艺、质控的优化及产品代工服务; |
6 | 质检 | 1.宿主细胞蛋白质、宿主细胞DNA、细菌内毒素; 2.源自培养液/纯化试剂/工艺步骤等添加物(如消泡剂、有机溶剂、抗生素、蛋白酶、活化/偶联试剂) 3.结构确证图谱、质量研究图谱、稳定性研究图谱 4.核酸电泳、蛋白电泳、免疫印迹; 5.生物活性检测。 |
7 | 稳定性研究 | 高温、光照、振荡、冻融、氧化、加速试验和长期试验(三批代表性工艺规模样品的6个月加速试验和12个月的长期试验) |
8 | 非临床研究 | 药效(量效关系)、生物利用度、肝脏代谢和药物相互作用研究,中毒迹象、致死原因、病理、遗传毒性、致癌性、生育力、胚胎发育、围产期毒性、幼龄动物试验、妊娠前、妊娠期、哺乳期以及幼年发育期使用,局部耐受性、免疫相关毒性等研究。 |
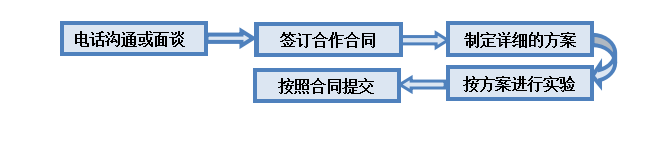
4.服务流程
5.联系方式
垂询电话:0371-67999699;邮箱:bioswzx@126.com
Copyright © 河南省生物工程技术研究中心 版权所有 ICP备案:豫ICP备09035453号-2
注册地址:河南省郑州市郑东新区商务外环路12号7层3号
实验室地址:河南省郑州市郑上路81号 邮编:450001
电话:18803718896 传真:0371-67999699 技术支持:FEEDOO